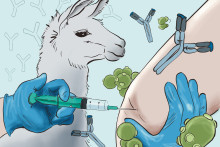
‘Ik was benieuwd of er muziek in zat’, vertelt Karperien over de ontstaansgeschiedenis van Orthos Medical, de Twentse spin-off die hij vijf jaar geleden oprichtte met Theo Verrips, hoogleraar aan Universiteit Utrecht. ‘Ik was bezig met de ontwikkeling van applicaties van tissue engineering en Theo had een heel interessante technologie, gebaseerd op antilichamen van lama’s. Ik wilde weten of die technologieën bij elkaar te brengen waren.’
Dat bleek inderdaad het geval te zijn. Orthos Medical richt zich op artrose, een gewrichtsaandoening waar ongeveer anderhalf miljoen Nederlanders aan lijden. De precieze oorzaak is onbekend, maar de aandoening leidt altijd tot de afbraak van kraakbeen aan het uiteinde van de botten in een gewricht. Het membraan in het gewrichtskapsel gaat ontstekingsstoffen aanmaken, de gewrichtsvloeistof verliest langzaam zijn smerende functie, botuiteinden worden brozer en veranderen van vorm. Het gevolg: stramheid en pijn bij het bewegen, vaak in het knie-, heup-, of schoudergewricht.
Tegen de pijn van een chronische aandoening als artrose kan een patiënt dagelijks pijnstillers slikken. Het medicijn komt zo echter in het hele lichaam terecht, wat op de langere termijn vervelende bijwerkingen kan hebben. Door antilichamen heel gericht in het gewricht te spuiten, is het wellicht mogelijk om de pijn heel lokaal te bestrijden.
‘De pijn wordt veroorzaakt door groeifactoren die vrijkomen en inwerken op de zenuwcellen’, legt Karperien uit. ‘Als we antilichamen laten binden aan die groeifactoren, worden ze verwijderd door macrofagen, een soort opruimcellen.’ De oorzaak van de ziekte verdwijnt daar niet mee, hoewel Karperien hoopt dat pijnverlichting de vicieuze cirkel van ontsteking en afbraak helpt te doorbreken die artrose zo kenmerkt. Maar waarom is daar lamabloed voor nodig, welke rol speelt tissue engineering en werkt het eigenlijk wel?
Lamabloed
Antilichamen, of antistoffen, zijn eiwitten die ons beschermen tegen ziekten. Ze binden zich aan indringers, zoals virussen en bacteriën, waarna het lichaam ze opruimt. Zo krijgen de ziekteverwekkers niet de kans om onze cellen binnen te dringen. Lamabloed bevat antilichamen die heel geschikt zijn om te gebruiken voor medicatie. ‘De anti-lichamen hebben een veel lager molecuulgewicht en zijn tot tien keer kleiner dan menselijke antilichamen’, zegt Karperien. ‘Ze zijn echter net zo effectief. Verder zijn ze heel stabiel: ze kunnen goed tegen temperatuurwisselingen en blijven intact in organische oplosmiddelen. Met conventionele antilichamen zouden we dit niet kunnen doen.’
Dat wil overigens niet zeggen dat voor elke behandeling anti-lichamen uit lamabloed nodig zijn: Orthos Medical wil de anti-lichamen uit lamabloed laten namaken door gistcellen. Schotel gistcellen de juiste DNA-sequentie voor die codeert voor het betreffende antilichaam en ze gaan enthousiast deze antilichamen produceren.
Dat de antistoffen zo klein zijn, heeft ook een nadeel: hierdoor kunnen ze weer snel uit het gewricht weglekken. En patiënten willen natuurlijk liever niet dagelijks een injectie met nieuwe antistoffen in hun gewrichten krijgen. Dit probleem is te omzeilen met polymeren die ook gebruik worden in de tissue engineering, de specialiteit van Karperien. ‘We verpakken de antistoffen in bio-afbreekbare polymeren en maken zo hele stabiele structuren die de antistoffen langzaam vrijgeven. Zo hoeft de patiënt maar eens in de paar maanden naar de dokter voor een nieuwe prik.’
Rattenloopjes
Klinkt goed, maar werkt het ook? Bij ratten in elk geval wel, zegt Karperien. De onderzoekers behandelden ratten met artrose en deden vervolgens een pijntest. Daarbij moet de rat over een gevoelige plaat lopen die meet hoeveel druk het beestje uitoefent met elk van zijn pootjes. Een gezonde rat heeft een evenwichtig loopje, een rat met pijn gaat een beetje strompelen, oftewel meer druk met de ene poot uitoefenen dan met de ander. De eerste resultaten laten zien dat ratten met artrose na toediening van de antilichamen een beter loopje hebben, dus minder pijn.
Voor hoeveel ratten dit geldt en hoeveel beter ze precies lopen, kan Karperien nog niet zeggen: de experimenten lopen nog. Hij kan dus nog niet verwijzen naar gepubliceerde resultaten, die door onafhankelijke collega’s kritisch zijn bekeken. Toch is hij optimistisch. ‘De resultaten zijn veelbelovend. In het optimistische scenario zullen we het begin 2024 uitproberen op hondpatiënten. Een klinisch experiment op mensen zit eind 2025, begin 2026 in de planning. Dat wil zeggen, als alles meezit en er geen tegenslagen zijn.’
Zulke tegenslagen zijn niet ondenkbaar. In de eerste plaats zouden we al verlost zijn van behoorlijk wat nare welvaartsziekten, wanneer mensen als ratten zouden reageren op experimentele medicijnen. Helaas is dat niet zo, mensen en ratten verschillen erg van elkaar. Verder is het mogelijk dat het menselijk lichaam zich na een tijdje keert tegen de toegediende antistoffen, zegt Karperien. ‘Wat je ziet bij de behandeling van reumatische artritis met antilichamen, is dat het lichaam zelf antilichamen gaat vormen tegen de ingespoten anti-lichamen. Daardoor worden ze minder effectief en moet de arts hogere concentraties gaan inspuiten. Het is denkbaar dat dit hier ook gebeurt.’
Dat hij hier niet erg bang voor is, komt doordat de gebruikte lamabloed-antistoffen zo klein zijn. ‘Ze bevatten alleen het gedeelte van het eiwit dat bindt aan het antigeen, de groeifactor NGF die pijn veroorzaakt’, legt Karperien uit. ‘Dat gedeelte lijkt erg op alle antilichamen die ons immuunsysteem ook zelf aanmaakt. Ons lichaam is dus niet snel genegen om die structuur als lichaamsvreemd te zien.’
Botsende belangen
De hoogleraar besteedt ruim een 20% van zijn tijd aan onderzoek voor zijn spin-off. Naast Orthos Medical richtte hij nog twee andere medische spin-offs op, Hy2Care en LipoCoat. Die combinatie van onderzoek en ondernemen maakt zijn werk juist zo interessant, vindt hij. ‘Het hebben van een bedrijf naast wetenschappelijk onderzoek zie ik als de manier om ook echt impact te maken. Je kunt fantastisch onderzoek doen op de universiteit, maar er zijn teveel voorbeelden van onderzoek dat in schoonheid sterft op de labtafel. Als ik echt impact wil maken, moet wat ik ontwikkel ook echt naar patiënten toe.’
Op de vraag, of onderzoek en ondernemerschap elkaar soms ook kunnen bijten, hoeft hij niet lang na te denken. ‘Er kunnen altijd situaties van botsende belangen ontstaan. Dan is het beleid dat iemand anders in de faculteit de beslissing neemt. Stel dat het bedrijf een aantal antigenen produceert die ik interessant vind om uit te testen in onderzoeksprojecten. Dan zou ik die moeten kopen van het bedrijf. Iemand anders zou daar dan heel kritisch naar moeten kijken. Daarin neem ik dan geen beslissingen.’
De artikelen die recentelijk in de media verschenen over de overmatige invloed van het bedrijfsleven op universitair onderzoek, vindt hij ‘een beetje tendentieus’. ‘Ja, grote bedrijven als Shell en Philips sponsoren soms hooglerarenposities aan universiteiten. De universiteit maakt in al die gevallen een raamwerk van de werkzaamheden van de betreffende hoogleraar. Daarbij bedingt de universiteit altijd dat de wetenschappelijke vrijheid van de betreffende leerstoelhouder nooit in het geding mag komen. Het is niet zo dat Shell tot in detail gaat bepalen wat er gebeurt.’
Volgens de hoogleraar zou dat niet eens in het belang van de bedrijven zijn. ‘Grote bedrijven zitten daar, omdat ze weten dat wetenschappelijk onderzoek nodig is voor vernieuwing, ook voor vernieuwing van hun producten en van hun bedrijfsmodellen. Onderzoek binnen het bedrijf levert vaak veel minder creativiteit op, dan wanneer je onderzoek financiert aan de universiteit. Het is voor hen dus een manier om hoogwaardig onderzoek te laten uitvoeren. En als er dan nieuwe dingen uit komen, dan zitten zij op de eerste rij om het in hun bedrijf te incorporeren. Ik denk dat we dat juist graag moeten willen.’